Transporte passivo: entra e sai da célula sem gasto de energia.
Transporte ativo: fagocitose, pinocitose e exositose, gasta energia ATP
Osmose: passagem de líquido.
Soluções· hipotônicas (pouco sal); isotônicas (níveis iguais de sal); hipertônicas (muito sal).
Células animais: numa solução hipotônica ela incha até estourar, numa solução isotônica não acontece nada, numa solução hipertônica ela murcha.
Células vegetais: numa solução hipotônica incha, mas não estoura por causa da parede celular; numa solução isotônica não acontece nada, numa solução hipertônica a célula encolhe mas a parede fica a mesma coisa.
Organelas:
Reticulo endoplasmático: somente em células eucariontes (núcleo organizado) aumenta a superfície da célula. Existem dois tipos:
Liso ou agranular: sem ribossomos, armazena e transporta, faz a síntese dos lipídios.
Rugoso ou granular: com ribossomos aderidos a membrana, armazena e transporta e faz a síntese das proteínas.
Lisossomos: origem no aparelho de golgi por brotamento.
Tem como função promover a digestão intracelular.
Funde-se com os fagossomos ou pinossomos originados em uma bolsa chamada vacúolo digestivo.
São encontrados principalmente em células animais.
Peroxissomos: são pequenas vesículas que apresentam enzimas digestivas, são encontradas no citoplasma das células eucariontes.
Tem como função decompor o peróxido de hidrogênio H2O2 em H2O e O2. Além da degradação de gorduras e aminoácidos e desintoxicação celular.
Mitocôndria: tem 2 membranas
São organelas em forma de grânulos 0 ou bastonetes, revestidos por uma membrana dupla, sendo a externa lisa e a interna crespa. Quanto maior a atividade energética maior seu número.
Centríolos: são estruturas citoplasmáticas cilíndricas formadas por 9 conjuntos e 3 microtubulos.
Localiza-se na região mais densa do citoplasma, estão presentes nos seres eucariontes exceto nas angiospermas.
Tem como funções participar da divisão celular e formar cílios e flagelos.
Vacúolos: são espaços que ocorrem em todos os tipos de células, revestidos por uma membrana lipoprotéica. Nos vegetais esta membrana é chamada de tonoplastos, só ocorre em organismo eucarionte.
Tipos:
Vegetais: de suco celular/de reserva/água, clorofila, amido, ar
Animais:de reserva/ digestivos
Protozoários: contrácteis – movimento.
Plastos: ao organelas encontrados em células vegetais e nas algas protistas.
Podem ser incolores --> leucoplastos relacionados a armazenamento de substâncias
podem ser coloridos também--> cromoplastos relacionados com a fotossíntese
tipos: amiloplastos: amido; oleoplastos: óleos; proteoplastos: proteínas... estes são os leucoplastos.
Os cromoplastos são xantoplastos:amarelo; eritraplastos: vermelho; feoplastos: pardo e cloroplastos verde.
quarta-feira, 11 de novembro de 2009
segunda-feira, 19 de outubro de 2009
Bloco Econômico - Relatório
Relatório – Bloco econômico
Quando se tem o propósito de fazer uma união de nações, uma unificação em um determinado continente, a história não pode surgir do nada e sem propósito.
Toda essa idéia é baseada em “mercado comum”, e não há apenas um mercado que comanda. Como o nome já diz, não é apenas uma unificação de terras, os pensamentos começam entrar em acordo, mesmo sendo opostos e um exemplo disso é a União Européia.
Se for analisar a história deles, eles eram muito rivais, com pensamentos totalmente diferentes, mas a intenção de um ajudar o outro foi maior, não foi uma coisa fácil, pois em 50 anos há intrigas entre si. E quando se fala em intrigas, vêm as tentativas de unificação das Américas.
Esse acordo parece que nunca sai do papel, pois são mentalidades autoritárias na qual um quer mandar mais que o outro, e ninguém acaba entrando em nenhum acordo. Como, por exemplo, é a rivalidade do Brasil e da Argentina. Se no futebol já é assim, essa grande rivalidade, um odeia o outro, imagina então quando é para se tratar de negócios.
Para pensarmos em unificação da América do sul, há a dúvida que vai demorar para sair do papel, apesar de pouco tempo ainda, são governos com idéias opostas. O Brasil que tem o maior território, e a moeda mais forte, não estão conseguindo dominar isso, o processo pra dominar está complicado por causa da grande rivalidade,
Quem sabe esse bloco econômico não aconteceça de fato daqui há uns 50 anos como a União Européia.
By: Francielle Mota
Quando se tem o propósito de fazer uma união de nações, uma unificação em um determinado continente, a história não pode surgir do nada e sem propósito.
Toda essa idéia é baseada em “mercado comum”, e não há apenas um mercado que comanda. Como o nome já diz, não é apenas uma unificação de terras, os pensamentos começam entrar em acordo, mesmo sendo opostos e um exemplo disso é a União Européia.
Se for analisar a história deles, eles eram muito rivais, com pensamentos totalmente diferentes, mas a intenção de um ajudar o outro foi maior, não foi uma coisa fácil, pois em 50 anos há intrigas entre si. E quando se fala em intrigas, vêm as tentativas de unificação das Américas.
Esse acordo parece que nunca sai do papel, pois são mentalidades autoritárias na qual um quer mandar mais que o outro, e ninguém acaba entrando em nenhum acordo. Como, por exemplo, é a rivalidade do Brasil e da Argentina. Se no futebol já é assim, essa grande rivalidade, um odeia o outro, imagina então quando é para se tratar de negócios.
Para pensarmos em unificação da América do sul, há a dúvida que vai demorar para sair do papel, apesar de pouco tempo ainda, são governos com idéias opostas. O Brasil que tem o maior território, e a moeda mais forte, não estão conseguindo dominar isso, o processo pra dominar está complicado por causa da grande rivalidade,
Quem sabe esse bloco econômico não aconteceça de fato daqui há uns 50 anos como a União Européia.
By: Francielle Mota
domingo, 13 de setembro de 2009
quarta-feira, 2 de setembro de 2009
Coluna Vestibular
Unifesp
início 01/09 término 30/09
A unifesp terá usará a nota do enem, porém alguns cursos deverão se inscrever para segunda fase. Acesse o site e veja se o seu curso tem necessidade.
terça-feira, 1 de setembro de 2009
~> Resistor, Gerador, Receptor
Corrente Elétrica
É um fluxo ordenado de portadores de carga elétrica
- Sentido eletrônico = os portadores de cargas vão do potencial menor para o maior
exemplo:



É o aparelho elétrico que transforma energia elétrica em outra forma de energia que não seja só energia térmica, aqui a fórmula:

É um fluxo ordenado de portadores de carga elétrica
- Sentido eletrônico = os portadores de cargas vão do potencial menor para o maior
exemplo:

Para calcular a intensidade de uma corrente elétrica utilizamos a fórmula:
Q=I
T
Onde Q é a carga que é medida em colomb (C), T é medido em segundos(s) e I em Amper(A)
Resistência
Q=I
T
Onde Q é a carga que é medida em colomb (C), T é medido em segundos(s) e I em Amper(A)
Resistência
É a propriedade de alguns materiais de se oporem a passagem de corrente elétrica
Diferença de Resistor e Resistência é: Resistor é o equipamento eletronico e a resistência é o que o resistor faz
1ª Lei de Ohm
É a relação entre corrente, tensão e resistência, tendo a fórmula:
U=R.I
Sendo o U a tensão usando a médida de voltz(v), o R é a Resistência medida em Ohm (Ω), e o I que é a corrente, ou intensidade da corrente medida em Amper (A)
Quanto maior for a resistência a corrente será menor, quanto menor a resistência, maior será a corrente
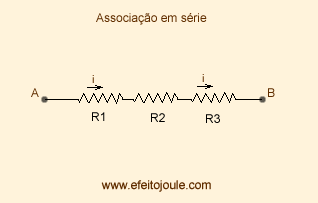
Associação de Resistores
- Série: Nesse daqui você apenas soma os resistores
R1+R2+R3=Rt
Exemplo:

Em resistores em série, a corrente será constante, o que varia é a tensão.
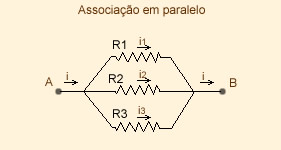
- Paralelo: Aqui trabalharemos com frações veja:

Aqui o desenho dos resistores:

Aqui em paralelo, a tensão é constante, e a corrente varia.
2ª lei de Ohm
Antes de tudo, a diferençã entre resistividade e condutividade é, resistividade é a propriedade do material, portanto não se modifica, condutividade se diminuirmos o tamanho do resistor, aumenta a condutividade.
Temos como Fórmula:

A medida de R é em Owm(Ω); o p em Ω.m, l em metros (m) e A em metro ao quadrado (m²)
.
Gerador
.
Nunca a resistencia do gerador eletrico será zero e por isso terá uma resistencia interna pois sempre existe uma dissipação de energia
- gerador ideal: é aquele que a resistencia interna e nula
portanto o U=E
- gerador ideal: é aquele que a resistencia interna e nula
portanto o U=E
- gerador de um curto circuito a formula é
E=Icc
R
Onde o E é a força eletromatriz(que recebe a voltagem) medida em Voltz(v), R é o resistor (Ω) e o Icc é a corrente de curto circuito medida em Amper
- Gerador real: é afonte de energia elétrica, que não consegue converter toda a energua química em energia elétrica(pilha). Aqui esta a fórmula:
U=E-r.i
U=Tensão (v)
E= Força eletromatriz (v)
r= Resistencia interna (Ω)
i = corrente (a)
Receptores
É o aparelho elétrico que transforma energia elétrica em outra forma de energia que não seja só energia térmica, aqui a fórmula:
U=E+r.i
Graficos

quinta-feira, 27 de agosto de 2009
Pontuação
A pontuação é algo muito importante pois através dela é possível fazermos pausas, darmos entonação e até mesmo mudar o sentido de uma frase.
Ex: Não, espere!
Não espere!
Não espere!
Vírgula
indica pequena pausa.
- NÃO se usa vírgula entre sujeito e predicado.
- NÃO se usa vírgula para separar complemento verbal, nominal e agente da passiva.
- Só se usa vírgula entre os termons anteriores se houver vários núcleos
Ex: Paz, amor, alegria queria para sua vida.
- Caso o último núcleo seja separado pela conjunção "e", não se usa vírgula.
Ex: Paz, amor e alegria eram os desejos de Dora.
- Se os vários núcleos forem separados pela conjunção "e" a vírgula é utilizada.
Ex: E um café, e um almoço, e uma soneca completariam seu dia.
- O adjunto adverbial colocado logo após o verbo não necessita vírgula.
Ex: Elas viajaram esta semana.
- Caso se mude a posição lógica, a vírgula se faz necessária.
Ex: Esta semana, elas viajaram.
- Quando só houver 1 palavra como adjunto adverbial é opcional o uso da vírgula.
Ex: Elas saíram hoje. / Hoje elas saíram. / Elas hoje saíram.
- O aposto normalmente separa-se com vírgula ou dois pontos.
Ex: Lúcia, professora de português, ensinou a matéria de sua prova.
- Se o vocativo for um termo sintaticamente isolado, SEMPRE entre vírgulas.
- Caso o período seja composto, se usa vírgula para separar orações coordenadas assindéticas ou sindéticas excluindo-se a conjunção aditiva "e".
Ex: Cantou, dançou e pulou muito no carnaval de 1995.
- Subordinadas substantivas só a oração apositiva deve conter vírgula ou dois pontos.
Ex: Houve uma eleição urgente, onde me elegeram capitão do time.
- Subordinadas adjetivas explicativas tê vírgula.
Ex: Os cães, que são danados, dão muitas alegrias.
- Subordinadas adverbiais = adjunto adverbial (levam vírgula quando estiverem fora de sua posição lógica)
Ponto e vírgula
É uma pausa mais forte que a vírgula e mais fraca que o ponto. Usa-se esporadicamente:
- Em um trecho com muitas vírgulas, para dar maior pausa.
- Separar partes de um período relativamente extenso.
- Em coordenadas adversativas, para evidenciar o contraste.
Ex: Pediu o divórcio; porém continuam amantes.
- Separar itens ou subitens.
quarta-feira, 26 de agosto de 2009
Parlamento Jovem
Pra quem for participar, no site da assembleia legislativa tem as informações de como montar sua lei, o regulamento, e edições antigas pra dar uma conferida:
Vestibulares
Ae galera, nesse espaço vamos colocar datas de inscrições no vestibular de diversas faculdades.
A que você vai prestar não está aqui ainda? Deixe um comentário e nós faremos o UPDATE :)
UFSCar - Universidade Federal de São Carlos
Inscrições de 1 à 30 de setembro 2009
R$ 75,00
Exclusivamente pela internet: www.vunesp.com.br
Provas: 13 e 14 de dezembro de 2009
Mais informações: www.vestibular.ufscar.br
FGV
Inscrições já abertas no site: http://www.fgv.br/vestibular/vestibular.asp
R$ 150,00
Prazo máximo de inscrição: 28/09/2009
Data da prova: Baixe o manual referente a sua carreira no site e confira.
USP
Inscrições 28/08/2009 à 11/09/2009
Exclusivamente pelo site: www.fuvest.br
R$ 100,00
Prova da 1ª fase 22/11/2009
Mais informações: www.fuvest.br
Unicamp
Inscrições já abertas, ultimo dia 06/10/2009
Faculdade de Medicina de Jundiaí
até 20/11/2009
terça-feira, 25 de agosto de 2009
~> Química Orgânica - Cadeias do Carbono
~> Nomeando Cadeias
Agora vimos como dar nomes aos carbonos segundo o seu número, número de ligações e pela sua cadeia, mas para nomearmos temos que seguir uma regra:
1º Função: Temos que começar contando o número de carbonos primeiro pela função, sendo ela ou um hidrocarboneto, um alcool entre outros,
exemplo:
CH2 - CH2 - CH - OH
CH3
Temos que nomear primeiro pela função (que veremos agora a seguir), aqui vemos que por causa do OH, isso é um alcool então contaremos a partir do Carbono próximo ao OH, Vendo que tem quatro Carbonos, pela nomenclatura é um but, e já que não tem nenhuma ligação dupla nem tripla, temos a nomeclatura, an, e pela função ser um álcool, pega o sufixo ol, juntando, tem um Butan-1-ol , sendo esse 1 para mostrar aonde que esta o alcool ligado ao carbono
2º Ligação: Agora o segundo critério para nomenclatura é a ligação, se ela é dupla, tripla ou única.
Exemplo: OH
CH2=CH-CH - CH3
A ligação dupla estaá no primeiro carbono, só que temos que começar a contagem de carbonos apartir da função, entao o nome ficará But-3en-2ol onde o 3 mostra a ligação dupla no terceiro carbono, e o 2 mostra a função.
3º Ramificação: Depois disso tudo começamos a ver as ramificações, que ficam fora da cadeia principal.
Exemplo:
CH=C-CH2-OH
CH3 CH3
Para acharmos a ramificação tempos que pegara cadeia que tenha mais numeros de carbonos,
então desdobrando fica assim:
CH3-CH=C-CH2-OH
.................CH3
E aqui esta a ramificação entao o nome vai ficar 3Metil But-3en-1ol
~> Hidrocarbonetos
Hidrocarbonetos são compostos orgânicos formados por apenas carbono e hidrogênio e tem como sufixo "o".
Alcano
- Cadeia aberta e saturada
- Fórmula molecular geral: CnH2n+2 (Onde n é o número de carbonos)
Exemplo:
H3C - CH2 - CH2 - CH3 ( lembrando o que já vimos, isso é um butano)
Contando os carbonos sabemos que tem 4, e hidrogênios 10, para sabermos se é um alcano colacamos na fórmula.
C4H4.2+2
C4H8+2
C4H10, e aqui está a fórmula molecular.
Alceno
-Cadeia aberta e insaturada por uma única ligação dupla
-Fórmula molecular geral: CnH2n
Exemplo:
H3C-CH=CH2 (Esse é o propeno)
C3H3.2
C3h6 fórmula molecular geral
Alcino
- Cadeia aberta e insaturada por uma única ligação tripla
- Fórmula molecular geral: CnH2n-2
Exemplo:
H3C - C = C - CH3 (Esse é o Butino)
C4H4.2 -2
C4H6
Obs.: Podem haver hidrocarbonetos que não sejam alcanos, alcenos, alcinos e nem cicloalcano e cicloalceno, por ter mais do que um ligação dupla ou tripla.
CicloAlcano
- Cadeia fechada e saturada
- Fórmula molecular geral: CnH2n
Exemplo:

(reparamos que os Ciclos formam figuras geométricas)
C6H6.2
C6H12, essa é a fórmula molecular geral
CicloAlceno
- Cadeia fechada e insaturada por uma única ligação dupla
- Fórmula molecular geral: CnH2n-2
Exemplo:
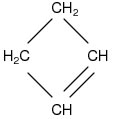
C4H4.2-2
C4H6, essa é a fórmula molecular
~> Álcool
Tem como sufixo "ol", e sempre são ligados a uma hidroxila (OH)
Estrutura:
R-OH
(R de radical)
Exemplo:
CH3-CH2-CH2-OH
Propanol
~> Aldeido
Tem como Sufixo "al"
Estrutura:

Exemplo:

Pentanal
~> Cetona
Tem como sufixo"ona"
Estrutura:

Exemplo:

Butanona
~> Ácido Carboxilico
Tem como nome "ácido + __________óico"
Estrutura:

Exemplo:

~> Éter
Tem como nome "R'menor-oxi-R''maior"
Exemplo:
CH3-CH2-O-CH2-CH2-CH3: Etóxipropano
Diferencias de Éter, Aldeido e Cetona:
O Éter deixa uma cadeia heterogênea, o oxigênio não tem ligação dupla.
Aldeido deixa a cadeia homogênea e sempre esta ligado a um carbono primário
Cetona deixa a cadeia homogênea, e sempre esta ligado a um carbono secundário
~> Fenol
Quando um composto estiver ligado a um grupo de OH ligado diretamente a um carbono do anel aromatico(Benzeno) temos o fenol, como nome "___hidroxibenzeno"
Estrutura

~> Haleto Orgânico
Quando encontramos elementos da familia dos halogêneos (7A na tabela periodica) ligado à carbonos, e recebem o nome como "nome do ´halogêneo + nome da cadeia"
Estrutura:
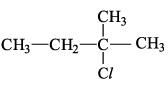
Nome:
2Metil Cloro butano
~>Ésteres
É a transformação entre um ácido e um alcool(este processo chama-se esterificação) e recebe o nome como "R'ato de R''ila" (R = radical)
Estrutura:
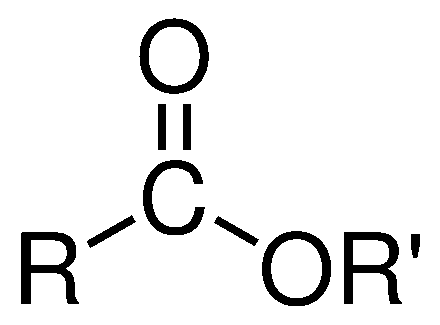
Exemplo:
.............O
.............║
H3C − C − O − CH3
Etanoato de Etila
~> Cloreto de Ácido
Recebe o nome como "Cloreto de _______"
Estrutura:

~> Sais Orgânicos
Estes composto derivam de um acido carboxilico e uma base, recebe o nome como "Cadeiaato de Sódio(Na) ou potassio(K)"
Nome:

Pentanoato de Potassio
~> Aminas
São compostos orgânicos derivados do NH3 éla substituição de um ou mais hidrogênio, recebe o nome como"_____amina"
Nomes:


~> Amida
Recebe o nome como "_______amida"
Estrutura:
 ou
ou 
Nomes:


Agora vimos como dar nomes aos carbonos segundo o seu número, número de ligações e pela sua cadeia, mas para nomearmos temos que seguir uma regra:
1º Função: Temos que começar contando o número de carbonos primeiro pela função, sendo ela ou um hidrocarboneto, um alcool entre outros,
exemplo:
CH2 - CH2 - CH - OH
CH3
Temos que nomear primeiro pela função (que veremos agora a seguir), aqui vemos que por causa do OH, isso é um alcool então contaremos a partir do Carbono próximo ao OH, Vendo que tem quatro Carbonos, pela nomenclatura é um but, e já que não tem nenhuma ligação dupla nem tripla, temos a nomeclatura, an, e pela função ser um álcool, pega o sufixo ol, juntando, tem um Butan-1-ol , sendo esse 1 para mostrar aonde que esta o alcool ligado ao carbono
2º Ligação: Agora o segundo critério para nomenclatura é a ligação, se ela é dupla, tripla ou única.
Exemplo: OH
CH2=CH-CH - CH3
A ligação dupla estaá no primeiro carbono, só que temos que começar a contagem de carbonos apartir da função, entao o nome ficará But-3en-2ol onde o 3 mostra a ligação dupla no terceiro carbono, e o 2 mostra a função.
3º Ramificação: Depois disso tudo começamos a ver as ramificações, que ficam fora da cadeia principal.
Exemplo:
CH=C-CH2-OH
CH3 CH3
Para acharmos a ramificação tempos que pegara cadeia que tenha mais numeros de carbonos,
então desdobrando fica assim:
CH3-CH=C-CH2-OH
.................CH3
E aqui esta a ramificação entao o nome vai ficar 3Metil But-3en-1ol
~> Hidrocarbonetos
Hidrocarbonetos são compostos orgânicos formados por apenas carbono e hidrogênio e tem como sufixo "o".
Alcano
- Cadeia aberta e saturada
- Fórmula molecular geral: CnH2n+2 (Onde n é o número de carbonos)
Exemplo:
H3C - CH2 - CH2 - CH3 ( lembrando o que já vimos, isso é um butano)
Contando os carbonos sabemos que tem 4, e hidrogênios 10, para sabermos se é um alcano colacamos na fórmula.
C4H4.2+2
C4H8+2
C4H10, e aqui está a fórmula molecular.
Alceno
-Cadeia aberta e insaturada por uma única ligação dupla
-Fórmula molecular geral: CnH2n
Exemplo:
H3C-CH=CH2 (Esse é o propeno)
C3H3.2
C3h6 fórmula molecular geral
Alcino
- Cadeia aberta e insaturada por uma única ligação tripla
- Fórmula molecular geral: CnH2n-2
Exemplo:
H3C - C = C - CH3 (Esse é o Butino)
C4H4.2 -2
C4H6
Obs.: Podem haver hidrocarbonetos que não sejam alcanos, alcenos, alcinos e nem cicloalcano e cicloalceno, por ter mais do que um ligação dupla ou tripla.
CicloAlcano
- Cadeia fechada e saturada
- Fórmula molecular geral: CnH2n
Exemplo:

(reparamos que os Ciclos formam figuras geométricas)
C6H6.2
C6H12, essa é a fórmula molecular geral
CicloAlceno
- Cadeia fechada e insaturada por uma única ligação dupla
- Fórmula molecular geral: CnH2n-2
Exemplo:

C4H4.2-2
C4H6, essa é a fórmula molecular
~> Álcool
Tem como sufixo "ol", e sempre são ligados a uma hidroxila (OH)
Estrutura:
R-OH
(R de radical)
Exemplo:
CH3-CH2-CH2-OH
Propanol
~> Aldeido
Tem como Sufixo "al"
Estrutura:

Exemplo:

Pentanal
~> Cetona
Tem como sufixo"ona"
Estrutura:

Exemplo:

Butanona
~> Ácido Carboxilico
Tem como nome "ácido + __________óico"
Estrutura:

Exemplo:

~> Éter
Tem como nome "R'menor-oxi-R''maior"
Exemplo:
CH3-CH2-O-CH2-CH2-CH3: Etóxipropano
Diferencias de Éter, Aldeido e Cetona:
O Éter deixa uma cadeia heterogênea, o oxigênio não tem ligação dupla.
Aldeido deixa a cadeia homogênea e sempre esta ligado a um carbono primário
Cetona deixa a cadeia homogênea, e sempre esta ligado a um carbono secundário
~> Fenol
Quando um composto estiver ligado a um grupo de OH ligado diretamente a um carbono do anel aromatico(Benzeno) temos o fenol, como nome "___hidroxibenzeno"
Estrutura

~> Haleto Orgânico
Quando encontramos elementos da familia dos halogêneos (7A na tabela periodica) ligado à carbonos, e recebem o nome como "nome do ´halogêneo + nome da cadeia"
Estrutura:

Nome:
2Metil Cloro butano
~>Ésteres
É a transformação entre um ácido e um alcool(este processo chama-se esterificação) e recebe o nome como "R'ato de R''ila" (R = radical)
Estrutura:

Exemplo:
.............O
.............║
H3C − C − O − CH3
Etanoato de Etila
~> Cloreto de Ácido
Recebe o nome como "Cloreto de _______"
Estrutura:

~> Sais Orgânicos
Estes composto derivam de um acido carboxilico e uma base, recebe o nome como "Cadeiaato de Sódio(Na) ou potassio(K)"
Nome:

Pentanoato de Potassio
~> Aminas
São compostos orgânicos derivados do NH3 éla substituição de um ou mais hidrogênio, recebe o nome como"_____amina"
Nomes:


~> Amida
Recebe o nome como "_______amida"
Estrutura:
 ou
ou 
Nomes:


segunda-feira, 24 de agosto de 2009
~> Química Orgânica - Funções do Carbono
O carbono é considerado um dos elementos mais importantes do processo de formação da vida,é considerado o prinicpal elemento dos aminoácido, além da luz da agúa e de algunsoutros poucos elementos químicos.
O carbono puro pode ser encontrado em materiais inorgânicos como grafite e diamante, sendo o grafite a forma mais estável do carbono, que significa que nas condições do ambiente, é mais fácil o diamante virar grafite, pórem, essa transformação é lentíssima.
Alguns carbonos grafíticos:
- O coque, carvão vegetal, e o negro de fumo
Ciclo do Carbono:

Mas tudo bem, o que o carbono tem de tão especial?

- Ele é tretavalente, ou seja, pode ser feita quatro ligações(valências) com um átomo de carbono
- As quatro valência do carbono são equivalentes
- Os átomos de carbono se ligam formando cadeias carbônicas.

Estrutural: H-C=C-H
Estrutural Simplificada: CH2=CH2
 Tipos de Cadeia:
Tipos de Cadeia:

Nomenclatura de Cadeias Ramificadas
O carbono puro pode ser encontrado em materiais inorgânicos como grafite e diamante, sendo o grafite a forma mais estável do carbono, que significa que nas condições do ambiente, é mais fácil o diamante virar grafite, pórem, essa transformação é lentíssima.
Alguns carbonos grafíticos:
- O coque, carvão vegetal, e o negro de fumo
Ciclo do Carbono:

Mas tudo bem, o que o carbono tem de tão especial?

- Ele é tretavalente, ou seja, pode ser feita quatro ligações(valências) com um átomo de carbono
- As quatro valência do carbono são equivalentes
- Os átomos de carbono se ligam formando cadeias carbônicas.

Classificação dos Carbonos de uma Cadeia Carbônica:
Estrutural: H-C=C-H
Estrutural Simplificada: CH2=CH2
Carbono Primário: Esta ligado a somente um outro átomo carbono
Carbono Secundário: Esta ligado a dois átomos de carbono
Carbono Terciário: Esta ligado a três átomos de carbono
Carbono Quartenário: Esta ligado a quatro átomos de carbono
Veja segundo o exemplo, os Vermelhos são primários, os Azuis secundário, os Verdes terciários, e os Amarelos quaternários:
 Tipos de Cadeia:
Tipos de Cadeia:Aberta:
H3C - CH2 - CH2 - CH3
Fechada:

Saturada:
CH3-CH3
Insaturada
CH2=CH2
Nomenclatura de Cadeias Carbonicas:
Os nomes dos compostos orgânicos que vamos estudar se compõe de um prefixo, um infico e um sufixo, cada parte trazendo uma informação imporatante para estrutura da substância:
Composição de um nome | ||
Prefixo | Infixo | Sufixo |
| met = apenas 1 carbono et = 2 carbonos prop = 3 carbonos but = 4 carbonos pent = 5 carbonos hex = 6 carbonos hept = 7 carbonos oct = 8 carbonos non = 9 carbonos dec = 10 carbonos . . . | an: Só há ligações simples (-) en: Indica ligação dupla(=) in: Indica ligação tripla (=) | o para os Hidrocarbonetos |
Nomenclatura de Cadeias Ramificadas
Podemos entender as ramificações como sendo derivados dos hidrocarbonetos de que se retirou um hidrogêneo, sempre precisando de um ligação para entrar em estabilidade
Assinar:
Postagens (Atom)


